细胞是生命的基石。一些细胞类型好单独生长,悬浮。但是,细胞中的大多数是整合在较大3D基体(如组织)中的粘附细胞。这些细胞与同一组织中的相邻细胞或与相邻却不同组织的界面处的相邻细胞相互作用。这可以是肌腱和骨骼之间的自然界面,或者对于植入物或生物膜而言,可以是人造界面。控制细胞-基体和细胞-细胞相互作用的力对其结构和功能很重要,对其量化可以更好地了解组织和界面的机械强度以及其中的相关故障。为此,单细胞力谱测量是一个强有力的工具。
Flex-FPM — 单细胞粘附力光谱的标准工具
原子力显微镜(AFM)已被广泛地用于研究单细胞水平上的细胞-基体和细胞-细胞相互作用[Helenius 等 (2008), Moreno-Encerrado 等 (2017)]。 执行单细胞力谱时细胞通常被化学绑定到悬臂上。但是,此方法存在一些缺点。化学绑定将可获得的大粘附力限制在几百纳牛顿。此外,它需要很多悬臂才能获得结论性的结果。当在延长的孵育时间(数小时至数天)后研究粘附细胞时,此力范围的限制尤其麻烦,因为力可能超过微牛顿范围。在研究细胞的融合层时尤其如此。在这里,除了通常研究的基体粘附以外,细胞与细胞之间的相互作用力也有贡献。
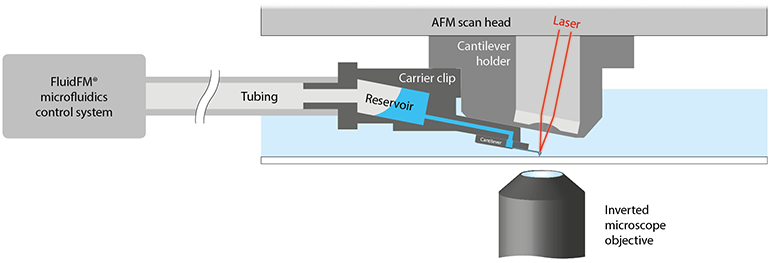
Flex-FPM (Fig. 1) 克服了这两个主要限制。Flex-FPM是结合了FlexAFM 原子力显微镜和FluidFM的灵活工具。细胞粘附测量是在ETH苏黎世由Prof. Julia Vorholt 和 Dr. Tomaso Zambelli小组率先开始的。使用 FluidFM™技术,不同细胞类型可通过悬臂内管道的负压被附在悬臂上。已证明FluidFM可测量许多不同细胞类型(例如哺乳动物细胞,酵母细胞和细菌细胞)的细胞基体粘附力。与化学绑定相比,使用FluidFM仅需几秒钟的接触时间即可施加大得多的力。 哺乳动物的细胞基体粘附的可觉察分离力大概达到几微牛顿范围[Potthoff 等 (2012); Potthoff 等 (2014)]. 不同表面纹理上的数据集显示细胞基体粘附与表面纹理深度的强烈相关性。这些粘附力测量可以帮助表面纹理的合理设计,以改善心血管植入物如具有内皮细胞的支架的覆盖率。这种内皮化对于防止血液与异物的相互作用至关重要。内皮化不足会导致炎症反应,急性血栓形成或慢性狭窄,即边缘腔变窄[Potthoff 等 (2014)]. 尽管力很大,力的分辨率仍然足以测量来自细胞外基质的单膜系链的粘附力。例如,用于单细胞力谱实验以研究细菌粘附力[Potthoff 等 (2015)].
通过抽吸法的附着不仅牢固而快速,而且是可逆的。因此,相同的FluidFM&trade探针可以连续用于多个细胞。曾经使用一个悬臂测量了超过200种不同的酵母细胞。这是在变化的环境条件下一天内完成的[Potthoff 等 (2012)]。使用倒置光学显微镜可以轻松进行细胞选择。使用荧光标记根据细胞的形状(形态),细胞大小或特定蛋白质的存在来选择细胞。同样对于哺乳动物细胞,实验量也高于化学绑定法。哺乳动物细胞的细胞表面与悬臂的相互作用比酵母细胞的相互作用更为复杂。这会导致更多的非特异性粘附,因此需要在实验之间清洁悬臂。业界已经建立了使用胰蛋白酶以酶促方式清洁悬臂的方案[Potthoff et al. (2014)]或用化学方法在次氯酸钠溶液中清洁[Jaatinen 等 (2016)]。清洁后,新的细胞可直接吸附,而无需像常规化学绑定时要有的涂覆步骤。
细胞-细胞粘附力
最近,FluidFM™细胞粘附力测量已扩展到研究细胞间的相互作用。这可以是细胞(在悬臂上)和下面的基体上细胞之间的力(图2A),也可以是细胞与融合层中其周围细胞之间的力(图2B)。
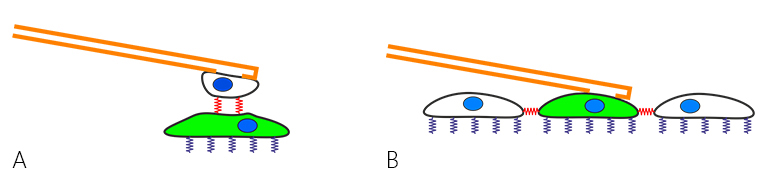
波士顿东北大学Prof. Tanya Konry 小组的Dr. Noa Cohen 用Flex-FPM系统研究细胞间粘附力,以更深入地了解肿瘤的进展和转移情况 [Cohen 等 (2017)].
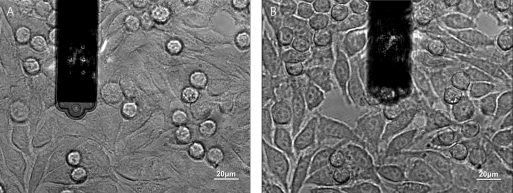
Figure 3 显示了 fig. 2 A 中描述的方法的光学图像,它被 Cohen 用于本研究。
细胞被吸上悬臂探针 C)吸有细胞的FluidFM探针在细胞间粘附测量中。
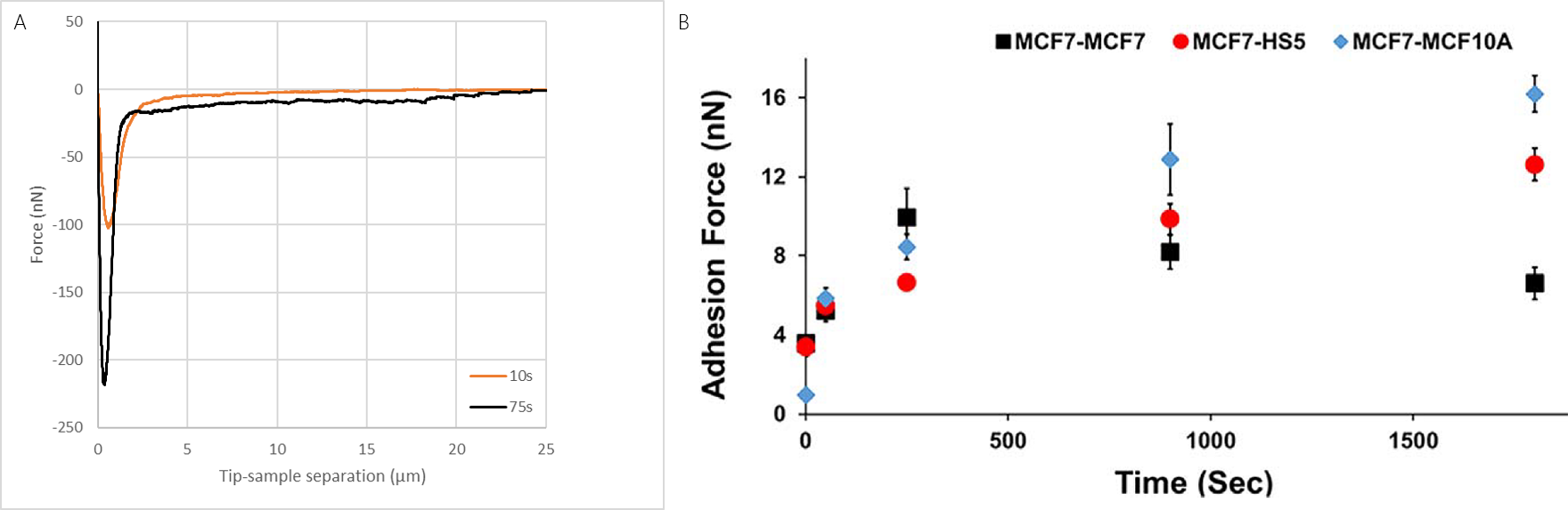
将单个MCF7乳腺癌细胞固定在悬臂上。然后将细胞推到固定在基质上的不同细胞类型上。发现MCF7癌细胞与不同细胞类型之间测量的细胞粘附力随着培养时间而有不同的发展。在这些实验中,细胞的可逆结合使得可以用相同的探针来测不同的细胞间力(图4),从而更好地比较测量值。
来自维尔茨堡大学Prof. Jürgen Groll小组的Dr. Ana Sancho广泛研究了上皮细胞融合层中细胞与其相邻细胞之间的相互作用(图2B)[Sancho 等 (2017)]. 图5显示悬臂从融合层(A)拾取细胞。拾取后,可以看到原细胞位置的空白区域(B)。同样,可以使用倒置显微镜基于细胞大小和细胞形状来选择感兴趣的上皮细胞。
我们发现来自脐动脉的人类内皮细胞具有强大的细胞间力(图6A和B)。通过过量所谓的 (MSX1)蛋白可以显著降低这种细胞间力。MSX1诱导内皮细胞向间质转化。这种转变涉及心血管发育和发病的过程。除了这些粘附实验之外,Flex-FPM系统还被用于纳米压痕测量。在此情况下,悬臂吸附胶体珠并记录在细胞上的力曲线。
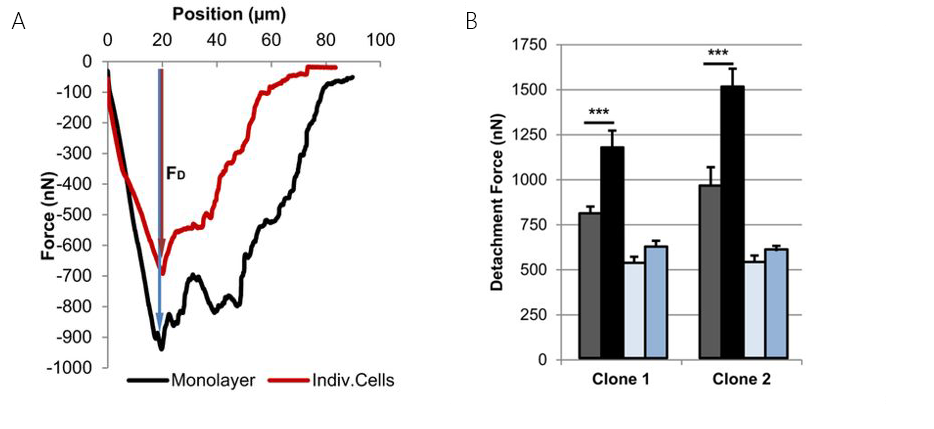
这两个例子都大大得益于 Flex-FPM提供的 FluidFM™ 技术。在融合层的情况下,高达1.5μN以上的粘附力消除了化学绑定力以研究细胞间粘附力。在这两例情况下,可逆的结合为实验提供了必要的省时以获得足够的统计数据。
引用文章
Jonne Helenius, Carl-Philipp Heisenberg, Hermann E. Gaub, and Daniel J. Muller (2008). Single-cell force spectroscopy. Journal of Cell Science 121: 1785-1791; doi:10.1242/jcs.030999
Alberto Moreno‐Cencerrado, Jagoba Iturri, Ilaria Pecorari, Maria D.M. Vivanco, Orfeo Sbaizero, and José L. Toca‐Herrera (2017). Investigating cell‐substrate and cell–cell interactions by means of single‐cell‐probe force spectroscopy. Microscopy Research & Technique 80: 124-130; doi:10.1002/jemt.22706
Eva Potthoff, Orane Guillaume-Gentil, Dario Ossola, Jérôme Polesel-Maris, Salomé LeibundGut-Landmann, Tomaso Zambelli, and Julia A. Vorholt (2012). Rapid and Serial Quantification of Adhesion Forces of Yeast and Mammalian Cells. PLoS ONE 7: e52712; doi:10.1371/journal.pone.0052712
Eva Potthoff, Davide Franco, Valentina D’Alessandro, Christoph Starck, Volkmar Falk, Tomaso Zambelli, Julia A. Vorholt, Dimos Poulikakos, and Aldo Ferrari (2014). Toward a Rational Design of Surface Textures Promoting Endothelialization. Nano Lett. 14: 1069-1079; doi:10.1021/nl4047398
Eva Potthoff, Dario Ossola, Tomaso Zambelli, and Julia A. Vorholt (2015). Bacterial adhesion force quantification by fluidic force microscopy. Nanoscale 7: 4070; doi:10.1039/c4nr06495j
Leena Jaatinen, Eleanore Young, Jari Hyttinen, János Vörös, Tomaso Zambelli, and László Demkó (2016). Quantifying the effect of electric current on cell adhesion studied by single-cell force spectroscopy. Biointerphases 11: 011004; doi:10.1116/1.4940214
Noa Cohen, Saheli Sarkar, Evangelia Hondroulis, Pooja Sabhachandan, and Tania Konry (2017). Quantification of intercellular adhesion forces measured by fluid force microscopy. Talanta 174: 409-413; doi:10.1016/j.talanta.2017.06.038
Ana Sancho, Ine Vandersmissen, Sander Craps, Aernout Luttun, and Jürgen Groll (2017). A new strategy to measure intercellular adhesion forces in mature cell-cell contacts. Scientific Reports 7: 46152; doi:10.1038/srep46152

